本标准规定了食品中菌落总数(aerobicplatecount)的测定方法。
本标准适用于食品中菌落总数的测定。
2术语和定义

3.2 冰箱:2℃~5℃。
3.4 天平:感量为0.1g。3.3 恒温装置:48℃±2℃。
3.5 均质器。

3.7 无菌吸管:1ml(具0.01ml刻度)、10ml(具0.1ml刻度)或微量移液器及吸头。
3.8 无菌锥形瓶:容量250ml、500ml。
3.9 无菌培养皿:直径90mm。
3.11 放大镜或/和菌落计数器。加一个试管和配套试管塞(尺寸15*150mm)
4 培养基和试剂
4.2 菌落总数测试片
4.3 磷酸盐缓冲液
4.4 无菌生理盐水
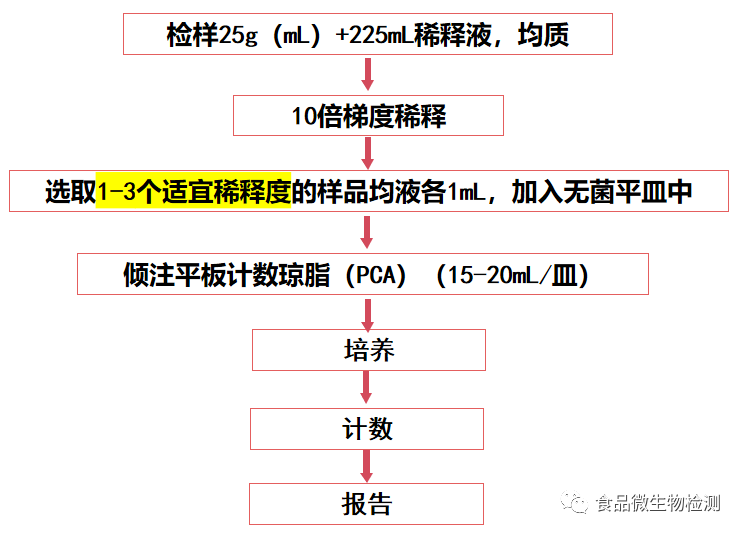
6 操作步骤
6.1 样品的稀释
6.1.1 固体和半固体样品:称取25g样品置于盛有225ml磷酸盐缓冲液或生理盐水的无菌均质杯内,8000r/min~10000r/min均质1min~2min,或放入盛有225ml稀释液的无菌均质袋中,用拍击式均质器拍打1min~2min,制成1∶10的样品匀液。
6.1.2 液体样品:以无菌吸管吸取25ml样品置盛有225ml磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成1∶10的样品匀液。
6.1.3 用1ml无菌吸管或微量移液器吸取1∶10样品匀液1ml,沿管壁缓慢注于盛有9ml稀释液的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用1支无菌吸管反复吹打使其混合均匀,制成1∶100的样品匀液。
6.1.4 按6.1.3操作,制备10倍系列稀释样品匀液。每递增稀释一次,换用1次1ml无菌吸管或吸头。
6.1.5 根据对样品污染状况的估计,选择1个~3个适宜稀释度的样品匀液(液体样品可包括原液),在进行10倍递增稀释时,吸取1ml样品匀液于无菌平皿内,每个稀释度做两个平皿。同时,分别吸取1ml空白稀释液加入两个无菌平皿内作空白对照。
6.1.6 及时将15ml~20ml冷却至46℃~50℃的平板计数琼脂培养基(可放置于48℃±2℃恒温装置如:恒温水浴箱中保温)倾注平皿,并转动平皿使其混合均匀。
6.2 培养
6.2.1 待琼脂凝固后,将平板翻转,36℃±1℃培养48h±2h。水产品30℃±1℃培养72h±3h。如果样品中可能含有在琼脂培养基表面弥漫生长的菌落时,可在凝固后的琼脂表面覆盖一薄层琼脂培养基(约4ml),凝固后翻转平板,按6.2.1条件进行培养。
6.2.2 如使用菌落总数测试片,应按照测试片所提供的相关技术规程操作。
6.3 菌落计数
6.3.1 可用肉眼观察,必要时用放大镜或菌落计数器,记录稀释倍数和相应的菌落数量。菌落计数以菌落形成单位(colony-formingunits,cfu)表示。
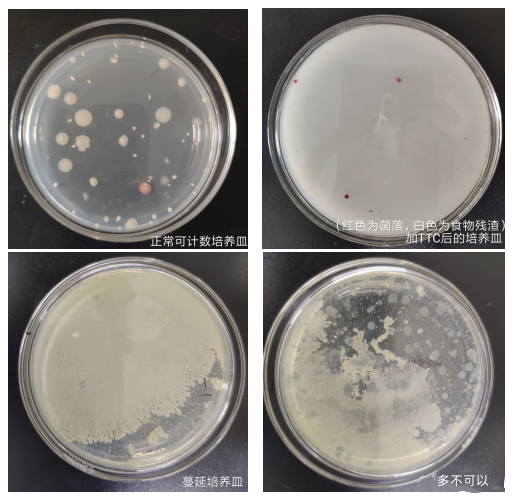
6.3.2 选取菌落数在30 cfu~300 cfu之间、无蔓延菌落生长的平板计数菌落总数。低于30cfu的平板记录具体菌落数,大于300cfu的可记录为多不可计。每个稀释度的菌落数应采用两个平板的平均数。
6.3.3 其中一个平板有较大片状菌落生长时,则不宜采用,而应以无片状菌落生长的平板作为该稀释度的菌落数;若片状菌落不到平板的一半,而其余一半中菌落分布又很均匀,即可计算半个平板后乘以2,代表一个平板菌落数。
6.3.4 当平板上出现菌落间无明显界线的链状生长时,则将每条单链作为一个菌落计数。
7 结果与报告
7.1 菌落总数的计算方法

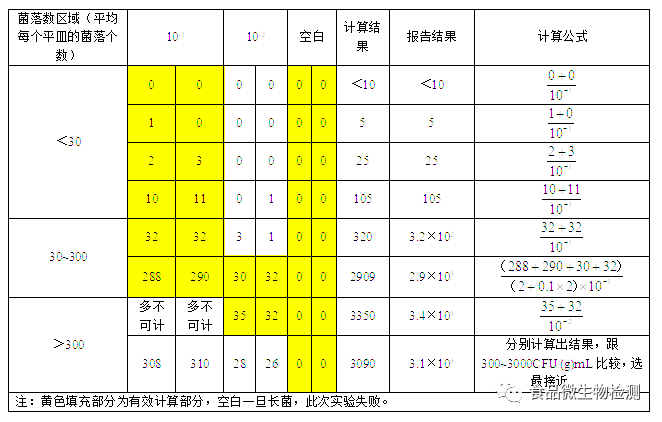
7.1.3 若所有稀释度的平板菌落数均<30cfu,则应按稀释度最低的平均菌落数乘以稀释倍数计算。
7.1.4 若所有稀释度的平板上菌落数均>300cfu,则对稀释度最高的平板进行计数,其他平板可记录为多不可计,结果按平均菌落数乘以最高稀释倍数计算。
7.1.5 若所有稀释度(包括液体样品原液)平板均无菌落生长,则以小于1乘以最低稀释倍数计算。
7.1.6 若所有稀释度的平板菌落数均不在30cfu~300cfu 之间,其中一部分<30cfu 或>300cfu 时,则以最接近30cfu或300cfu的平均菌落数乘以稀释倍数计算。
7.2.1 菌落数小于100cfu 时,按“四舍五入”原则修约,以整数报告。
7.2.2 菌落数大于或等于100cfu 时,第3位数字采用“四舍五入”原则修约后,取前2位数字,后面用 0代替位数;也可用10的指数形式来表示,按“四舍五入”原则修约后,采用两位有效数字。
7.2.3 若空白对照上有菌落生长,则此次检测结果无效。
7.2.4 称重取样以 cfu/g为单位报告,体积取样以 cfu/ml为单位报告。








